
- Pengarang Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Terakhir diubah 2025-01-22 17:01.
NS Rumus Empiris untuk magnesium oksida adalah MgO . Magnesium adalah kation +2 dan oksida adalah -2 anion. Karena muatannya sama dan berlawanan, kedua ion ini akan terikat bersama dalam rasio atom 1 banding 1.
Ditanyakan juga, apa rumus empiris magnesium oksida?
MgO
Juga Tahu, apa yang dimaksud dengan rumus MgO? Magnesium oksida (MgO), atau magnesium, adalah mineral padat higroskopis putih yang terjadi secara alami sebagai periklas dan adalah sumber magnesium (lihat juga oksida). Ketika " magnesium oksida " biasanya mengacu pada MgO , magnesium peroksida MgO 2 adalah juga dikenal sebagai senyawa.
Juga tahu, apa rumus teori magnesium oksida?
yang benar rumus untuk magnesium oksida adalah MgO , rasio 1,0 banding 1,0.
Bagaimana Magnesium oksida terbentuk?
oksigen dan magnesium bergabung dalam reaksi kimia untuk membentuk senyawa ini. Setelah terbakar, itu membentuk bubuk putih dari magnesium oksida . Magnesium memberikan dua elektron kepada atom oksigen untuk membentuk produk tepung ini. Ini adalah reaksi eksotermik.
Direkomendasikan:
Apa rumus empiris oktan?

C8H18 Di sini, apa rumus empiris oktan c8h18? NS rumus empiris oktan $$C_{8}H_{18}$$ adalah: A. B. C. Demikian pula, apa rumus empiris c2h6o2? Rumus Molekul dan Empiris Pertanyaan Menjawab Tuliskan rumus empiris senyawa berikut:
Bagaimana Anda menemukan rumus empiris dengan persentase?

Transkrip Bagilah setiap % dengan massa atom unsur. Bagilah setiap jawaban MEREKA dengan yang terkecil. Sesuaikan angka-angka ini ke dalam rasio bilangan bulat terendah
Apa rumus empiris kafein?
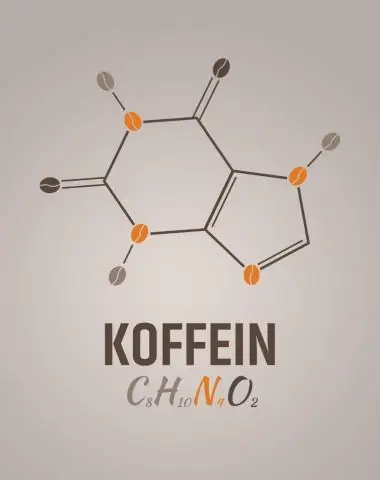
2 Jawaban. C8H10N4O2 adalah rumus molekul untuk kafein
Berapa persentase massa magnesium dalam magnesium oksida?

Persen komposisi berdasarkan unsur Elemen Simbol Persen Massa Magnesium Mg 60,304% Oksigen O 39,696%
Apa yang dimaksud dengan rumus empiris dan rumus molekul?
Rumus molekul memberi tahu Anda berapa banyak atom dari setiap unsur dalam suatu senyawa, dan rumus empiris memberi tahu Anda rasio unsur yang paling sederhana atau paling tereduksi dalam suatu senyawa. Jika rumus molekul suatu senyawa tidak dapat direduksi lagi, maka rumus empirisnya sama dengan rumus molekul
