
- Pengarang Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Terakhir diubah 2025-01-22 17:01.
Klorin isotop dengan 18 neutron memiliki kelimpahan 0,7577 dan nomor massa 35 sma. Untuk menghitung rata-rata massa atom, kalikan fraksi dengan nomor massa masing-masing isotop , lalu tambahkan bersama-sama.
Demikian pula, berapa rata-rata tertimbang dari semua isotop suatu unsur?
Menggunakan massa yang berbeda isotop dan seberapa berlimpah masing-masing isotop adalah, kita dapat menemukan rata-rata massa atom an elemen . Massa atom an elemen adalah rata-rata tertimbang massa atom dalam sampel yang terjadi secara alami dari elemen . Massa atom biasanya dilaporkan dalam satuan massa atom.
apa yang memiliki massa 1 sma? Satuan massa atom (dilambangkan AMU atau sma) didefinisikan sebagai tepat 1/12 massa atom karbon-12. Atom karbon-12 (C-12) memiliki enam proton dan enam neutron dalam nukleusnya. Dalam istilah yang tidak tepat, satu AMU adalah rata-rata dari proton massa istirahat dan neutron massa istirahat.
Kedua, bagaimana Anda menghitung persen kelimpahan menggunakan massa atom?
Ubah setiap persen kelimpahan ke dalam bentuk desimal dengan membaginya dengan 100. Kalikan nilai ini dengan massa atom dari isotop itu. Tambahkan bersama untuk setiap isotop untuk mendapatkan rata-rata massa atom.
Apa perbedaan antara massa atom dan berat atom?
Massa atom (MA) adalah massa dari sebuah atom . Tunggal atom memiliki sejumlah proton dan neutron, sehingga massa tegas (tidak akan berubah) dan merupakan jumlah dari jumlah proton dan neutron di dalam atom . Berat atom adalah rata-rata tertimbang dari massa dari semua atom suatu unsur, berdasarkan kelimpahan isotop.
Direkomendasikan:
Bagaimana Anda menemukan basis log 2 dari 10?

Log102=0.30103 (perkiraan) Logaritma basis-10 dari 2 adalah bilangan x sehingga 10x=2. Anda dapat menghitung logaritma dengan tangan hanya menggunakan perkalian (dan membaginya dengan pangkat 10 - yang hanya merupakan pergeseran digit) dan fakta bahwa log10(x10)=10⋅log10x, meskipun tidak terlalu praktis
Bagaimana Anda menemukan nilai yang tepat dari cos 7pi?

VIDEO Ditanyakan juga, bagaimana Anda menemukan nilai pasti dari cot 7pi 6? Ranjang bayi 7Pi / 6 Radian The pondok dari 7pi / 6 radian adalah 3, sama dengan pondok dari 7pi / 6 radian dalam derajat. Untuk mengganti 7pi / 6 radian ke derajat dikalikan 7pi / 6 sebesar 180 ° / = 210 °.
Bagaimana Anda menemukan bentuk komponen dari vektor yang diberikan besar dan sudut?
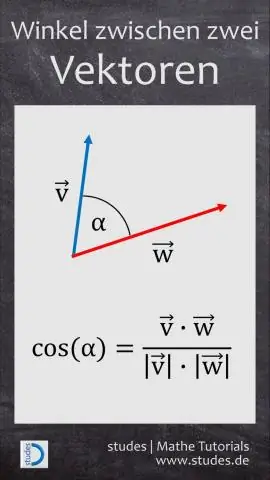
VIDEO Dengan mempertimbangkan hal ini, apakah 0 adalah vektor satuan? A vektor satuan adalah vektor yang memiliki besaran 1. Notasi tersebut mewakili norma, atau besaran, dari vektor v. Dasar vektor satuan apakah saya = (1, 0 ) dan j = ( 0 , 1) yang panjangnya 1 dan memiliki arah sepanjang sumbu x positif dan sumbu y masing-masing.
Bagaimana Anda menemukan intersep kemiringan dari sebuah tabel?
Untuk mencari perpotongan y, substitusikan kemiringan untuk m dalam rumus y = mx + b, dan substitusikan pasangan terurut yang diberikan dalam tabel untuk x dan y dalam rumus, kemudian selesaikan b. Akhirnya, substitusikan nilai m dan b ke dalam rumus y = mx + b untuk menulis persamaan garis
Bagaimana sebuah sel seperti sebuah pabrik?

Sel adalah unit kehidupan terkecil yang dapat bereplikasi secara mandiri, dan sering disebut sebagai 'bahan penyusun kehidupan'. Sel seperti pabrik. Semua organel memiliki tempat dalam sel dan bekerja sama untuk mengikuti suatu fungsi. Sama seperti pabrik yang memiliki bagian dan bagian yang berbeda untuk menjalankan suatu fungsi
