
- Pengarang Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Terakhir diubah 2025-01-22 17:02.
Karena mereka tinggi muatan nuklir efektif, halogen adalah sangat elektronegatif . Oleh karena itu, mereka adalah sangat reaktif dan bisa memperoleh elektron melalui reaksi dengan elemen lainnya. Halogen dapat berbahaya atau mematikan bagi organisme biologis dalam jumlah yang cukup.
Yang juga perlu diketahui adalah, mengapa golongan 17 memiliki keelektronegatifan tertinggi?
Keelektronegatifan meningkat sepanjang periode, dan menurun ke bawah kelompok . Oleh karena itu, fluor memiliki keelektronegatifan tertinggi dari semua elemen. Karena fluor memiliki tujuh elektron valensi, hanya membutuhkan satu elektron lagi untuk mencapai konfigurasi gas mulia (delapan elektron valensi).
Orang mungkin juga bertanya, apa keelektronegatifan halogen? Definisi dari keelektronegatifan adalah tarikan unsur untuk mendapatkan lebih banyak elektron. Jadi VIIA atau halogen akan memiliki yang tertinggi keelektronegatifan dari setiap elemen di baris mereka, atau periode. Florine nomor 9 F199 memiliki yang tertinggi keelektronegatifan dari setiap elemen dalam tabel periodik di 4.0.
Juga tahu, halogen mana yang memiliki keelektronegatifan tertinggi?
Fluor
Mengapa halogen disebut demikian?
Unsur golongan 17 adalah disebut halogen karena halogen adalah kata Yunani yang berarti 'menghasilkan garam'. halogen termasuk fluor, klor, brom, yodium, dan astatin. Mereka semua adalah non-logam. Mereka bereaksi dengan logam untuk membentuk senyawa ditelepon garam.
Direkomendasikan:
Mengapa senyawa ionik memiliki titik leleh dan titik didih yang tinggi?

Senyawa ionik memiliki titik leleh dan titik didih yang tinggi karena terdapat gaya tarik-menarik elektrostatik yang kuat antara ion-ion yang bermuatan berlawanan dan oleh karena itu diperlukan energi yang besar untuk memutuskan gaya ikatan yang kuat antar ion
Mengapa zat murni memiliki titik leleh yang lebih tinggi?

Peran gaya antarmolekul Gaya-gaya ini harus diganggu ketika suatu zat meleleh, yang membutuhkan masukan energi. Masukan energi diterjemahkan ke suhu tinggi. Jadi, semakin kuat gaya yang mengikat padatan, semakin tinggi titik lelehnya
Mengapa etil alkohol memiliki titik didih lebih tinggi daripada metil alkohol?

Etanol memiliki titik didih yang lebih tinggi daripada Metanol. Oleh karena itu, diperlukan lebih banyak energi untuk mengatasi gaya antarmolekul, yang mengakibatkan peningkatan titik didih/lebur
Mengapa dataran tinggi disebut dataran tinggi?

Jawaban: Dataran tinggi disebut 'dataran tinggi' karena menyerupai meja dalam artian dataran tinggi dan tinggi. Pada dasarnya, 'Plateau' adalah kata Perancis untuk tableland dan seperti namanya, itu adalah wilayah daratan yang sangat datar di alam dan yang ditinggikan di atas permukaan laut
Mengapa air memiliki titik leleh yang tinggi?
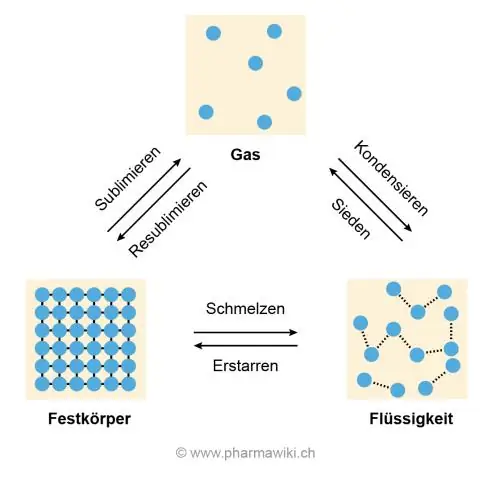
Alasan tingginya suhu leleh dan titik didih adalah ikatan hidrogen antara molekul air yang menyebabkan mereka saling menempel dan menolak untuk ditarik terpisah, itulah yang terjadi ketika es mencair dan air mendidih menjadi gas
