
- Pengarang Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Terakhir diubah 2025-01-22 17:02.
Jika Anda perlu menggunakan ini persamaan , cukup temukan tombol "ln" di kalkulator Anda. Kamu bisa menggunakan persamaan Arrhenius untuk menunjukkan pengaruh perubahan suhu pada konstanta laju - dan karena itu pada laju reaksi. Misalnya, jika konstanta laju menjadi dua kali lipat, maka laju reaksi juga akan meningkat.
Demikian pula, apa rumus energi aktivasi?
Menentukan Energi Aktivasi. Perhatikan bahwa ketika persamaan Arrhenius disusun ulang seperti di atas, itu adalah persamaan linier dengan bentuk y = mx + b; y adalah ln(k), x adalah 1/T, dan m adalah -EA/R. Energi aktivasi untuk reaksi dapat ditentukan dengan mencari lereng dari garis.
Selain itu, apa satuan untuk K? Dari pola unit kita dapat menyatakan bahwa untuk reaksi orde kinetik n, unit dari k adalah: k = 1/tc^(n-1), mengingat bahwa c adalah jumlah per liter yang dinyatakan dalam massa atau molaritas dan n adalah orde kinetik.
Lalu, berapa satuan energi aktivasi pada persamaan Arrhenius?
di mana k mewakili konstanta laju, EA adalah energi aktivasi , R adalah konstanta gas (8,3145 J/K mol), dan T adalah suhu yang dinyatakan dalam Kelvin. A dikenal sebagai faktor frekuensi, memiliki unit dari L mol-1 S-1, dan memperhitungkan frekuensi reaksi dan kemungkinan orientasi molekul yang benar.
Berapakah konstanta laju k?
NS tingkat konstan , k , adalah proporsionalitas konstan yang menunjukkan hubungan antara konsentrasi molar reaktan dan kecepatan dari suatu reaksi kimia. NS tingkat konstan dapat ditemukan secara eksperimental, dengan menggunakan konsentrasi molar reaktan dan orde reaksi.
Direkomendasikan:
Bagaimana perawat menggunakan persamaan linier?

Bidang perawatan kesehatan, termasuk dokter dan perawat, sering menggunakan persamaan linier untuk menghitung dosis medis. Persamaan linier juga digunakan untuk menentukan bagaimana obat yang berbeda dapat berinteraksi satu sama lain dan bagaimana menentukan jumlah dosis yang tepat untuk mencegah overdosis dengan pasien yang menggunakan banyak obat
Bagaimana cara menyelesaikan persamaan kuadrat menggunakan hukum faktor nol?

Dari sini kita dapat menyimpulkan bahwa: Jika produk dari dua bilangan adalah nol, maka salah satu atau kedua bilangan tersebut adalah nol. Artinya, jika ab = 0, maka a = 0 atau b = 0 (termasuk kemungkinan bahwa a = b = 0). Ini disebut Hukum Faktor Null; dan kami sering menggunakannya untuk menyelesaikan persamaan kuadrat
Kapan sebaiknya Anda menggunakan rangkaian aktivitas, bagaimana Anda menggunakannya?

Ini digunakan untuk menentukan produk reaksi perpindahan tunggal, dimana logam A akan menggantikan logam B lain dalam larutan jika A lebih tinggi dalam seri. Serangkaian aktivitas dari beberapa logam yang lebih umum, tercantum dalam urutan reaktivitas yang menurun
Kapan Anda harus menggunakan korelasi dan kapan Anda harus menggunakan regresi linier sederhana?
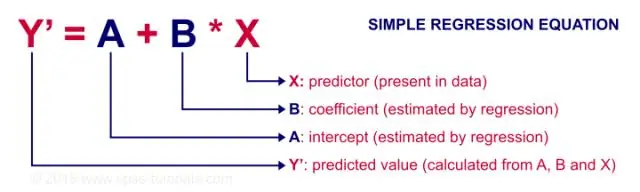
Regresi terutama digunakan untuk membangun model/persamaan untuk memprediksi respons kunci, Y, dari serangkaian variabel prediktor (X). Korelasi terutama digunakan untuk meringkas dengan cepat dan ringkas arah dan kekuatan hubungan antara sekumpulan 2 atau lebih variabel numerik
Bagaimana cara menyelesaikan persamaan linear menggunakan eliminasi Gauss?

Cara Menggunakan Eliminasi Gaussian untuk Menyelesaikan Sistem Persamaan Anda dapat mengalikan setiap baris dengan konstanta (selain nol). mengalikan baris tiga dengan -2 untuk memberi Anda baris tiga baru. Anda dapat mengganti dua baris apa pun. menukar baris satu dan dua. Anda dapat menambahkan dua baris bersama-sama. menambahkan baris satu dan dua dan menulisnya di baris dua
