
- Pengarang Miles Stephen [email protected].
- Public 2023-12-15 23:37.
- Terakhir diubah 2025-01-22 17:02.
Setiap elemen emisi spektrum berbeda karena setiap elemen mempunyai sebuah berbeda himpunan tingkat energi elektron. Emisi garis sesuai dengan perbedaan antara berbagai pasangan dari banyak tingkat energi. NS garis (foton) dipancarkan sebagai elektron jatuh dari orbital energi yang lebih tinggi ke energi yang lebih rendah.
Selain itu, mengapa elemen yang berbeda menghasilkan jumlah garis spektrum yang berbeda?
Frekuensi adalah karakteristik dari sifat-sifat inti dan angka elektron yang terdistribusi di antara bermacam-macam "kerang." Menurut mekanika kuantum, ada maksimum jumlah elektron diperbolehkan di setiap kulit terikat. Ini sebabnya elemen yang berbeda memiliki perbedaan frekuensi emisi diskrit.
Kedua, mengapa beberapa garis spektral lebih terang dari yang lain? Dalam hidrogen spektrum , beberapa garis spektral adalah lebih terang dari yang lain tergantung pada tingkat energi mereka. Ini garis terang menunjukkan bahwa elektron telah melompat dari tingkat energi yang lebih tinggi ke tingkat energi yang lebih rendah. Jadi dalam hidrogen spektrum beberapa garis adalah lebih terang dari yang lain.
Dalam hal ini, apa yang diwakili oleh warna yang berbeda dalam spektrum garis Mengapa spektrum untuk setiap elemen unik?
Setiap elemen mempunyai sendiri spektrum garis unik dan dengan demikian disebut sebagai "sidik jari" untuk elemen . NS spektrum untuk setiap elemen adalah unik karena setiap elemen mengandung jumlah elektron yang berbeda dan dengan demikian berbeda tingkat energi.
Mengapa setiap elemen memancarkan warna yang berbeda?
Pemanasan NS atom menggairahkan elektronnya dan mereka melompat ke tingkat energi yang lebih tinggi. Ketika elektron kembali ke tingkat energi yang lebih rendah, mereka memancarkan energi dalam bentuk cahaya. Setiap elemen memiliki A berbeda jumlah elektron dan berbeda kumpulan tingkat energi. Dengan demikian, setiap elemen memancarkan kumpulannya sendiri warna.
Direkomendasikan:
Apa yang menyebabkan garis-garis dalam spektrum emisi untuk unsur-unsur?

Garis emisi terjadi ketika elektron dari atom, elemen, atau molekul yang tereksitasi bergerak di antara tingkat energi, kembali ke keadaan dasar. Garis spektral dari elemen atau molekul tertentu yang diam di laboratorium selalu terjadi pada panjang gelombang yang sama
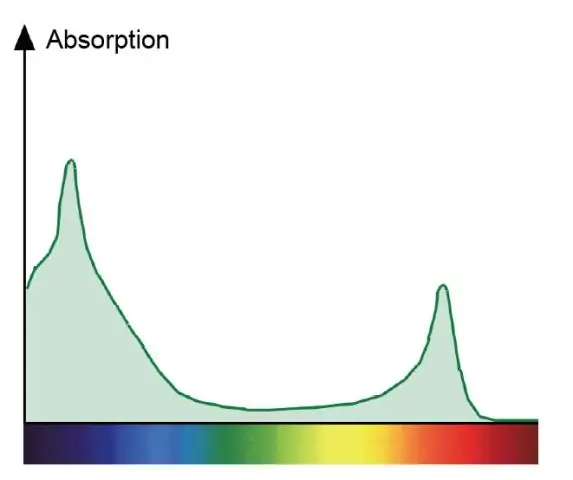
Mengapa ada garis-garis gelap dalam spektrum serapan?

Garis-garis dalam spektrum serapan gelap karena unsur tersebut menggunakan panjang gelombang cahaya tertentu untuk diserap agar dapat melompat ke kulit yang lebih tinggi dalam atomnya
Bagaimana spektrum emisi atom berbeda dari spektrum kontinu?

Spektrum kontinu: spektrum yang memiliki semua panjang gelombang tanpa celah pada rentang yang luas. Spektrum emisi: ketika sebuah elektron dalam keadaan tereksitasi bergerak ke tingkat energi yang lebih rendah, ia memancarkan sejumlah energi sebagai foton. Spektrum untuk transisi ini terdiri dari garis-garis karena tingkat energinya terkuantisasi
Apakah masuk akal untuk menemukan persamaan garis yang sejajar dengan garis tertentu dan melalui sebuah titik pada garis tertentu?

Persamaan garis yang sejajar atau tegak lurus dengan garis tertentu? Kemungkinan jawaban: Kemiringan garis sejajar adalah sama. Substitusikan kemiringan yang diketahui dan koordinat suatu titik pada garis lain ke dalam bentuk kemiringan titik untuk menemukan persamaan garis sejajar
Mengapa spektrum serapan klorofil a dan spektrum aksi fotosintesis berbeda?
Spektrum serapan menunjukkan semua warna cahaya yang diserap oleh tanaman. Spektrum aksi menunjukkan semua warna cahaya yang digunakan dalam fotosintesis. Klorofil adalah pigmen hijau yang menyerap merah dan biru dan berpartisipasi dalam fotosintesis secara langsung
