- Pengarang Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Terakhir diubah 2025-01-22 17:02.
Jadi, saat Anda bergerak turun satu grup pada tabel periodik, keelektronegatifan dari suatu unsur berkurang karena peningkatan jumlah tingkat energi menempatkan elektron terluar sangat jauh dari tarikan inti. Keelektronegatifan meningkat saat Anda bergerak dari kiri ke kanan melintasi periode pada tabel periodik.
Mengenai hal ini, mengapa keelektronegatifan menurun di seluruh golongan?
Keelektronegatifan . Bergerak ke bawah dalam kelompok , NS keelektronegatifan berkurang karena jarak yang lebih jauh antara inti dan kulit elektron valensi, sehingga mengurangi daya tarik, membuat atom kurang menarik elektron atau proton.
Selanjutnya, pertanyaannya adalah, apakah elektronegativitas memiliki kecenderungan? Semakin tinggi keelektronegatifan atom, semakin besar kemampuannya untuk menarik elektron bersama. NS keelektronegatifan atom meningkat saat Anda bergerak dari kiri ke kanan melintasi periode dalam tabel periodik. NS keelektronegatifan atom berkurang saat Anda bergerak dari atas ke bawah ke bawah satu golongan dalam tabel periodik.
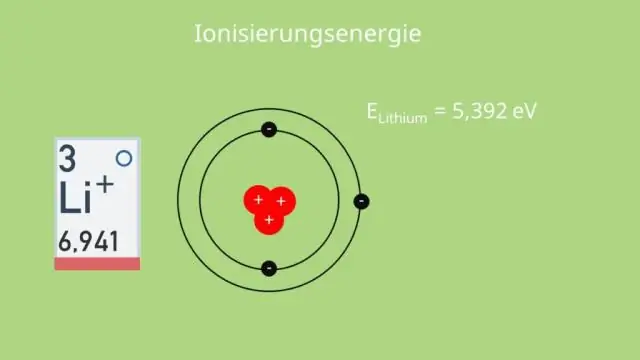
Orang mungkin juga bertanya, bagaimana tren energi ionisasi turun satu golongan?
Bergerak dari kiri ke kanan melintasi satu periode, jari-jari atom berkurang, sehingga elektron lebih tertarik ke inti (yang lebih dekat). Umum kecenderungan adalah untuk energi ionisasi untuk mengurangi bergerak dari atas ke bawah turun tabel periodik kelompok . Bergerak turun satu grup , kulit valensi ditambahkan.
Bagaimana kecenderungan nomor atom turun satu golongan?
- NS nomor tingkat energi meningkat saat Anda bergerak turun satu grup sebagai nomor elektron meningkat. Setiap tingkat energi berikutnya lebih jauh dari inti daripada yang terakhir. Oleh karena itu, atom radius bertambah seiring dengan kelompok dan tingkat energi meningkat. 2) Saat Anda bergerak melintasi suatu periode, atom radius berkurang.
Direkomendasikan:
Mengapa halogen memiliki keelektronegatifan tinggi?

Karena muatan inti efektifnya yang tinggi, halogen sangat elektronegatif. Oleh karena itu, mereka sangat reaktif dan dapat memperoleh elektron melalui reaksi dengan unsur lain. Halogen dapat berbahaya atau mematikan bagi organisme biologis dalam jumlah yang cukup
Bagaimana Anda tahu jika transformasi adalah satu ke satu?
Ketika transformasi linier digambarkan dalam matriks, mudah untuk menentukan apakah transformasi linier adalah satu-satu atau tidak dengan memeriksa ketergantungan linier dari kolom-kolom matriks. Jika kolom-kolomnya bebas linier, maka transformasi liniernya adalah satu-satu
Bagaimana Anda menentukan apakah suatu ikatan bersifat polar tanpa tabel keelektronegatifan?

Langkah 2: Identifikasi setiap ikatan sebagai polar atau nonpolar. (Jika perbedaan keelektronegatifan atom-atom dalam ikatan lebih besar dari 0,4, kita menganggap ikatan polar. Jika perbedaan elektronegativitas kurang dari 0,4, ikatan pada dasarnya nonpolar.) Jika tidak ada ikatan polar, molekulnya adalah nonpolar
Non logam apa yang satu golongan dengan timbal?

Kalsium. Apa non-logam dalam kelompok yang sama sebagai timbal? Karbon
Berapakah keelektronegatifan h2o?

Air, Hidrogen Ikatan Kutub memiliki elektronegativitas 2,0, sedangkan oksigen memiliki elektronegativitas 3,5. Perbedaan elektronegativitas adalah 1,5, yang berarti bahwa air adalah molekul kovalen polar
